آپوپتوزیس فرآیند حذف سلول هایی است که وظیفه بیولوژیک خود را در طی فرآیند رشد و هم ایستایی بافتی در ارگانهای چند سلولی انجام داده و به پایان رسانده اند. در طول دهه اخیر مکانیسم مولکولی درگیر در بروز پدیده آپوپتوزیس تا حد بسیار زیادی مشخص گردیده است. این پدیده فرایندی انرژی گیر است که محرکهای متعددی سبب آغاز آن می گردند که از آن جمله می توان به :
- · کاهش سطح هورمونهای رشد
- · کم شدن چسبندگی بین سلولی
- · تحریک رسپتور های پروآپوپتوتیک
- · آسیب DNA اشاره نمود[۱].
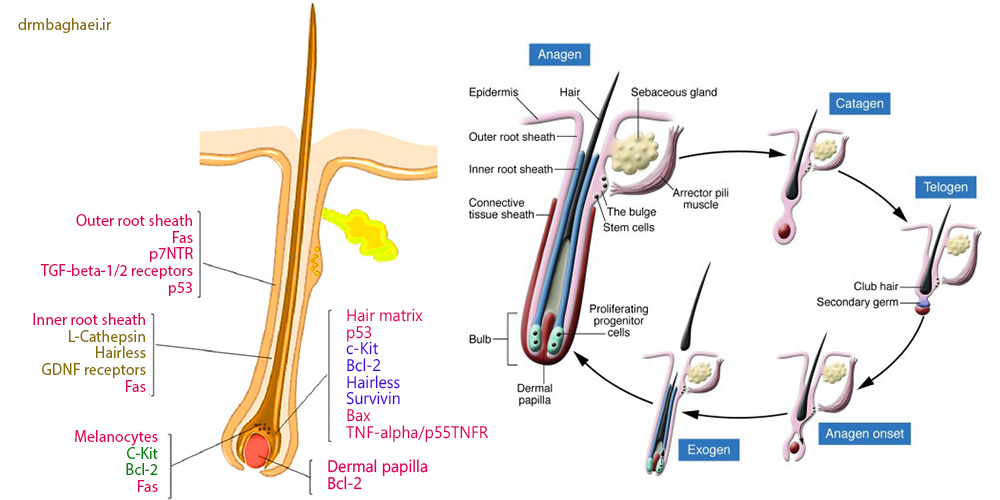
فولیکول مو ارگانی پوستی است که از دوران پس از جنینی فعالیت دوره ای نشان می دهد و همواره ۴ فاز رشد مختلف آناژن ،کاتاژن ، اگزوژن و تلوژن را طی می نماید. در طول رشد فولیکول و ساخت مو فعالیت فاکتور های محرک تکثیر و ازدیاد، تمایز و حیات بر سیر قهقرایی و نابودی فولیکولهای مو _که ناشی از فعالیت دسته ای از “سیگنالینگ پث وی” است که سبب بروز آپوپتوزیس در سلولهای فولیکول می گردد _ می گردد. [۲-۴]
مراحل آپوپتوزیس به چه صورت است؟
آپوپتوزیس برنامه چند مرحله ای مرگ سلولی است. از نظر مورفولوژیکی آپوپتوزیس با ایجاد چروکیدگی در سلول، ایجاد برآمدگی در ممبران سلولی و ایجاد پارگی در دیواره سلول همراه است که این فرایند با فاگوسیتوز اجسام آپوپتوتیک دنبال میگردد. روند آپوپتوزیس را می توان به چهار مرحله زیر تقسیم بندی نمود :
- مرحله آغازین
- مرحله واکنش درون سلولی
- پاره شدن دیواره سلول
- فاگوسیتوز [۱]
مراحل آغازین و واکنشهای درون سلولی
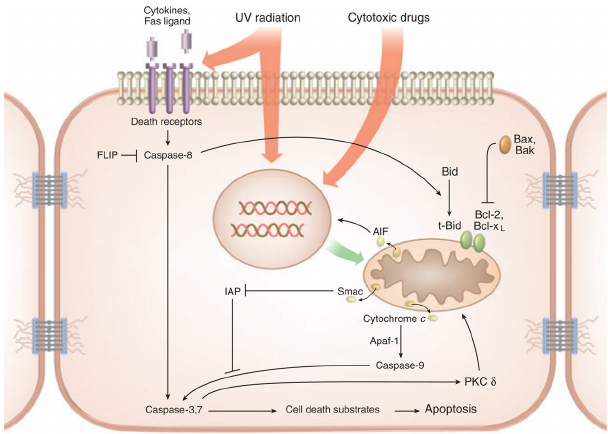
مسیر خارجی آپوپتوتیک با باند شدن لیگاند های خاص به اعضایی از خانواده (Death domain (DD ؛ از رسپتورهای ممبران فعال می گردد. همه رسپتور های مرگ یک دمین خارج سلولی غنی از سیستئین دارند که برای اتصال لیگاندها مورد نیاز است و علاوه براین چنین رسپتور هایی دارای دامین داخل سلولی خاص و لازمی نیز برای انتقال سیگنالها می باشند[۶،۵].
انتقال پیام و علامت دهی از طریق رسپتور های مرگ سبب بکارگیری مولکولهای خاص و تعدیل کننده متعدد داخل سلولی برای هر رسپتور آپوپتوتیک همانند:
(Fas-associated death domain protein, tumor necrosis factor (TNF) receptor 1–associated death domain, receptor-interacting protein ,
می گردد. که همه آنها دارای دمین فعال کننده رسپتور مرگ لازم برای تداخل با دمین های مشابه موجود در پروکاسپاز-۸ و۱۰ می باشند.
فعال سازی کاسپاز-۸ و ۱۰ موجب بکارگیری آنها در کمپلکسهای پیام رسان مرگ شده و سبب فعال سازی کاسپاز-۳ در طی مسیر مشترک آپوپتوتیک می گردد. کاسپاز -۸ همچنین ممکن است موجب فعال شدن پروتئین سیتوپلاسمی Bid گردد که پس از انتقال به داخل میتوکندری سبب آزاد سازی سیتوکروم C و در نتیجه آن بهم پیوستن مسیر های داخلی و خارجی آپوپتوزیس به یکدیگر می گردد [۶].
مسیر داخلی آپوپتوزیس نیز به واسطه اتفاقات متعددی که سرانجام سبب آزاد سازی سیتوکروم C از میتوکندری می شوند، فعال می شود. این فرایند توسط پروتئین هایی از خانواده Bcl-2 کنترل می گردند این پروتئین ها به دو گروه بزرگ تقسیم می گردند:
- پروتئین های مهار کننده آپوپتوزیس مانند : Bcl-2، Bcl-xl و Mcl-1
- پروتئین های محرک Apoptosis مانند : Bax, Bak, Bok, Bcl-xS, Bik, Bim, Bad و Bid
پروتئین های محرک Bim, Bad و Bid همچنین ممکن است به عنوان گیرنده هایی برای سلامت سلولی و تامین کننده فاکتور رشد نیز عمل نمایند.
Bim به عنوان یک حسگر سلامت سیتواسکلتون نیز عمل می نماید و فعالیت پرو آپوپتیک آن نیز توسط Dynein motor complex تنظیم میگردد. Bad نیز به عنوان یک حسگر کمبود و کاهش فاکتور رشد عمل می نماید، فقدان فاکتور های رشد حیاتی سبب دِ فسفریلیشن این پروتئین شده و منجر به Apoptosis می گردد[۷-۹].
پروتئین سیتوپلاسمیک Bid می تواند توسط کاسپاز -۸ ، گرانزیم B و کاتپسین به یک ایزوفرم ناقص به نام (tBid) شکسته شود که پس از انتقال به داخل میتوکندری سبب آزاد سازی سیتوکروم C و بروز Apoptosis گردد.سیتوکروم C پس از آزاد شدن به داخل سیتوپلاسم این ماده موجب بکار گیری مولکول تعدیل کننده کاسپاز Apaf-1 و آنزیم آغازگر آپوپتوزیس، پروکاسپاز- ۹ می گردد که این دو مولکول با هم هولوآنزیمی به نام آپوپتوزوم را شکل می دهند.
آپوپتوزوم ها موجب شکل گیری شکل فعالی از کاسپاز-۳ در طی مسیر مشترکی از Apoptosis میگردند. فعالیت کاسپاز -۳ ممکن است توسط اعضایی از خانواده پروتئین های مهار کننده آپوپتوزیس IAP که در سیتوزول قرار گرفته اند و از فعال سازی پرو کاسپاز ها ممانعت می نمایند مهار گردد. در طی فرآیند آپوپتوزیس فعالیتهای IAP ها توسط پروتئین Smac/DIABLO که از میتوکندری ترشح می گردد خنثی می گردد و پروتئین مورد نظر توانایی از کار انداختن IAP ها را دارا می باشد[۱۰].
مرحله متلاشی شدن سلول و فاگوسیتوز سلولهای آپوپتوتیک
هر دو مسیر خارجی و داخلی آپوپتوتیک توسط فعال شده کاسپاز -۳ شکل می گیرند و عقیده بر این است که این آنزیم کلیدی پروتئولیتیک قابلیت متلاشی نمودن و تخریب بسیاری از مواد داخل سلولی موادی همانند پروتئینهای ساختمانی و یا انتقال دهنده پیام ، فاکتورهای نسخه برداری و تنظیم کننده های ترمیم DNA و تنظیم کننده های متابولیسم RNA را دارد. به علاوه کاسپاز -۳ موجب شکستن دئوکسی ریبونوکلئاز فعال شده توسط کاسپاز می گردد که ترجمه می شود به داخل هسته و شکستن DNA را آغاز می نماید[۹و۱۱].
نتیجه فرایند تخریبی کاسپاز -۳ قطعات از کار افتاده و نا کارای کروماتین ،لیزوزوم ها، میتوکندری و دیگر بخشهای سلولی است که توسط بخشی از ممبران سلولی پوشیده شده و از نظر مورفولوژیکی تحت نام اجسام آپوپتوتیک قابل شناسایی است. در طول مرحله آخر آپوپتوزیس قطعه قطعه شدن سلولی و هسته با تغییراتی در ممبران سلول همراه می گردد که عبارتست از انتقال مکانی فسفاتیدیل سرین از بخش درونی ممبران به بخش بیرونی تا در نتیجه آن این قطعات توسط سلولهای همسایه ، ماکروفاژها و یا سلولهای دندریتیک شناسایی و قابلیت فاگوسیتوز بیابند[۱].
در طی این فرایند CD14 ،CD36 ،CD68، رسپتور های جاروب کننده A و رسپتور ویترونکتین توسط ماکروفاژ ها بیان می گردند و همه آنها قابلیت واکنش با مولکولهای متعدد تعیین کننده بیان سلولهای آپوپتوتیک مانند آنیونیک فسفولیپیدها ،فسفاتیدیل سرین و ICAM 3 را دارند. به علاوه پروتئینهای سرم همانند بتا-۲ گلیکوپروتئین و اجزای مکمل C1q میتوانند به سلولهای آپوپتوتیک باند شده و موجب افزایش حذفشان توسط ماکروفاژها گردند.
مقایسه فیزیولوژیک فولیکول مو با فرایند آپوپتوزیس
اگر چه کاتاژن به عنوان یک اتفاق قهقرایی در فرآیند رشد مو تلقی می گردد لیکن این پروسه یک تغییر وضعیت انرژی بر با هارمونی بسیار عالی است که تنظیم کننده نوسازی و تولد دوباره فولیکولهای مو به نحوی متوالی است. فاز کاتاژن ابتدا در سال۱۹۵۱ و ۱۹۶۱ با جزئیات توسط Kligman و straile و همکارانش شرح داده شد. کاتاژن از لحاظ مورفولوژیکی و عملکردی به ۸ زیر مرحله تقسیم می گردد که هر کدام از آنها با صفات تمایزی آپوپتوزیس خود طبقه بندی می گردند.
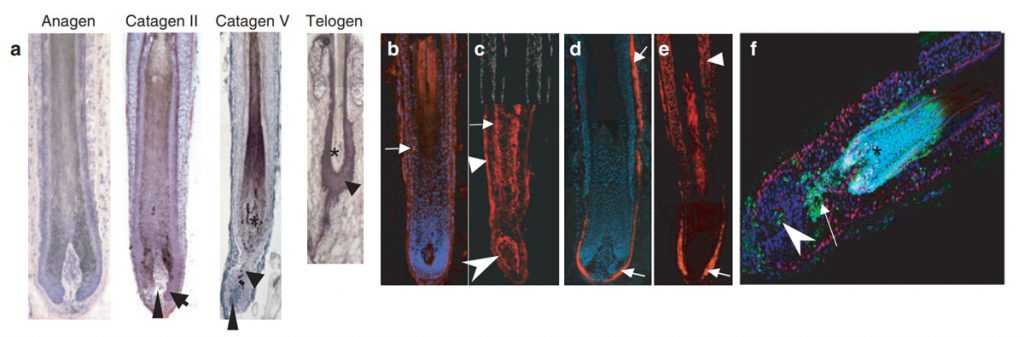
در طول سیکل رویش مو در جوندگان سلولهای آپوپتوتیک ابتدا توسط ایجاد لکهای TUNEL در مناطق ملانوژنیک فولیکول موی که اواخر فاز آناژن خود را می گذراند پدیدار می گردند. در ابتدای کاتاژن سلولهای آپوپتوتیک در ماتریکس فولیکول دیده می شود و مدتی بعد TNF در غلاف خارجی و داخلی ریشه دیده می شود(در مراحل میانی و بعدی کاتاژن) و سپس به وفور در لایه های اپی تلیال دیده می شود (اواخر کاتاژن).
در مراحل آخر فاز کاتاژن سلولهای + TUNEL در Club و Bulge هم دیده می شود. اما در انسان و موش سلولهای آپوپتوتیک هرگز در درمال پاپیلای فولیکول در فاز کاتاژن در شرایط فیزیولوژیکی دیده نمی شود. بنابراین در تشریح فضایی و زمانی سلولهای + TUNEL در فولیکول مویی که در فاز آناژن قرار دارد می توان گفت :
موجی آغازین از منطقه ملانوژنیک در اواخر آناژن آغاز شده و در مرحله ابتدایی کاتاژن به ماتریکس انتشار می یابد و سپس غلافهای نزدیک به مرکز و داخلی و خارجی ریشه و شافت مو در مراحل میانی و انتهایی کاتاژن انتشار می یابد. در بین سلولهای موجود در فولیکول و تنها جمع مشخص و معینی دارای استعداد افتراقی برای آپوپتوزیس می باشند. در این بین فیبروبلاستهای درمال پاپیلا و برخی از کراتینوسیتها و ملانوسیتهایی که برای بقا انتخاب شده اند در برابر آپوپتوزیس مقاوم می باشند.
در طول کاتاژن درمال پاپیلا به دسته ای از سلولهای ساکن و بی فعالیت بسیار نزدیک به اپی تلیوم فولیکول موی دارای سیر قهقرایی تبدیل میگردد که از ساب کوتیس به مرز بین درمیس /ساب کوتیس تغییر مکان می یابد تا با بخش خارجی اپی تلیوم فولیکول مو تماس یابد. در موتاسیون ژنی ریزش مو بی مویی، انهدام و از هم پاشیدگی درمال پاپیلا و اپی تلیوم فولیکول مو در طول کاتاژن سبب کاهش توان فولیکول برای بازگشت مجدد به فاز آناژن می گردد.
مکانیسم مولکولی Apoptosis در طول دوره کاتاژن فولیکول مو
داده های بدست آمده بر پایه مانیتورینگ سرنوشت ملانوسیتها در طول کاتاژن در موشهای Trp2-Lac2 ترانسژنیک بیان می کند که زیر مجموعه های مشخصی از ملانوسیتها که در Bulge در غلاف خارجی ریشه و در بالای درمال پاپیلا قرار گرفته اند حساسیتهای متفاوتی به Apoptosis را نشان می دهد.
مخصوصا Apoptosis تنها در ملانوسیتهای مشخصی که در بالای درمال پاپیلا قرار گرفته اند موجب بیان رسپتور Fas می گردد در حالیکه زیر مجموعه های دیگری که رسپتور C-Kit و Bcl-2 را بیان می کند که بیشترین دلیل بر زنده بودن کاتاژن است. بنابراین علامت دهی Fas می تواند با Apoptosis ملانوسیت در طول مدت کاتاژن همراه گردد. این عمل مشابه با اتفاقی است که بنظر میرسد پس از تماس فولیکول های مو با مواد شیمی درمانی صورت می پذیرد.
Stem cell factor/c-Kit و Bcl-2 دو مولکول مهم و داوطلبی هستند که ممکن است موجب بقا ملانوسیتها در طی کاتاژن گردند.
تخریب و از بین بردن ساختمان Stem cell factor/c-Kit یا تجویز آنتی بادی های خنثی کننده C-Kit موجب بروز Apoptosis و ناپدید شدن ملانوبلاستها در جنین موش شده است. Bcl-2 بخصوص موجب محافظت از سلولهای بنیادی ملانوسیتها در فولیکول مو در مقابل Apoptosis می گردد و کمبود Bcl-2 سبب حذف های آپوپتوتیک آنها و بوجود آمدن موهای خاکستری نارس و زود هنگام می شود.
به هرحال ارتباط بین مسیر Stem cell factor/c-Kit و پروتئینهای آنتی آپوپتوتیک میتوکندری در کنترل حیات فولیکول کاملا مشخص نیست.
Apoptosis در ماتریکس کراتینوسیتهای مو
تحقیقات صورت گرفته بر روی فولیکولهای موی انسان و موش نشان میدهد که Apoptosis در ماتریکس کراتینوسیتهای مو از طریق دو معبر داخلی و خارجی کنترل می گردد ساب یونیت p55 از رسپتور ممکن است در معبر آپوپتوتیک خارجی دخیل باشد و این رسپتور در ماتریکس مو در طول کاتاژن بیان می گردد و با درمان با TNF سبب افزایش TNF- alpha سلولهای + TUNEL در ماتریکس مو می گردد. همچنین TNF- alpha سبب افزایش انتقال آناژن به کاتاژن در فولیکول موی انسان در Vitro گردیده است. Apoptosis در ماتریکس کراتینوسیت های مو همچنین با فعال سازی معبر داخلی آپوپتوتیک همراه می باشد.
در طول دوره کاتاژن در موش نسبت Bcl2/Bax در ماتریکس کراتینوسیت های مو به نحو چشمگیری در مقایسه به آنچه در آناژن وجود دارد کاهش می یابد. پروتئین حیات بخش که متعلق به دسته IAP می باشد به طور گسترده ای در سلولهای تکثیر کننده ماتریکس مو بیان می گردد در حالی که بیان آن به طور تصاعدی در طول کاتاژن کاهش می یابد.
فاکتور رونویسی P53 همچنین نقش مهمی در تنظیم Apoptosis در ماتریکس کراتینوسیت های مو اعمال می نماید که عبارت است از فولیکولهای مو در فاز کاتاژن موشهایی که P53 ندارند سلولهای آپوپتوتیک کمتری دارند و دوره کاتاژن درآنها به میزان قابل توجهی در مقایسه با موشهای وحشی معمولی تاخیری می گردد.
P53 ممکن است سبب تقویت و ارتقاء معبر آپوپتوتیک در ماتریکس مو توسط تنظیم بیان پروتئین میتوکندریایی Bax گردد چنین بیانی در ماتریکس مو در طول دوره کاتاژن افزایش می یابد. فاکتور رونویسی بی مویی همچنین به عنوان یک تنظیم کننده مهم Apoptosis در فولیکول مو دخالت دارد.
در موش بی مو Apoptosis در ماتریکس مو به نحو فزاینده ای افزایش می یابد و سبب انتقال نارس فولیکول از آناژن به کاتاژن و گهگاهی تخریب درمال پاپیلا از اپیتلیوم فولیکولار و بروز بی مویی دائم می گردد. اخیرا نشان داده شد که پروتئین بی مویی به عنوان یک عامل مهم بازدارنده رونویسی رسپتور ویتامین D عمل می کند.
این امر مشخص می نماید که ارتباطی بین پروتئین بی مویی و رسپتور ویتامین D ممکن است در Apoptosis کراتینوسیتهای فولیکول مو مشارکت نمایند. جالب اینکه Apoptosis در ماتریکس مو به نحو بالایی در کراتین ۱۷ موش Knockout افزایش می یابد که این نخستین گواه بر این امر است که انهدام یک ساختمان پروتئینی ممکن است سبب Apoptosis در کراتینوسیتهای فولیکول مو گردد.
اما این سوال باقی می ماند که آیا حذف کراتین ۱۷ نتیجه فعال شدن مستقیم مسیر Apoptosis داخلی است یا Bim به عنوان یک حسگر سلامت سیتواسکلتون درگیر این امر است یا اینکه مکانیزمهای دیگری در این رابطه دخیلند. مکانیزم های اجرایی Apoptosis در موش و انسان به احتمال بسیار زیاد توسط عوامل زیر واسطه گری می گردد: کاسپاز۱،کاسپاز ۳،کاسپاز۴ و کاسپاز۷
این کاسپاز ها در طول دوره کاتاژن در ماتریکس مو بشدت بیان می گردند و احتمالا در فرایند های تخریب سلولی نیز نقش دارند.
آپوپتوزیس در غلاف خارجی ریشه مو
قبل و یا در طی دوره کاتاژن ،کراتینوسیتهای غلاف خارجی ریشه، مولکولهای متعدد و مهمی را به واسطه فرایند کاتاژن تولید و ترشح می نمایند که عبارتند از ایزوفرم کوتاه فاکتور رشد ۵ فیبروبلاست ، نوروتروفینها، فاکتور رشد تغییر شکل یافته بتا۱/۲ یا TGF-B 1/2 ،IGF binding protein 3 و ترمبوسپوندین-۱ .
بیان بیش از حد یکی از پروتئینهای آنتی آپوپتوتیک میتوکندری همچون Bcl2 وBcl-xl در کراتینوسیتهای غلاف خارجی ریشه سبب خاتمه یافتن نارس آناژن و شتاب گرفتن کاتاژن میشود و این درحالیست که کمبود و نقصان Fibroblast Growth Factor 5 دارای اثراتی بر عکس می باشد. چنین پدیده ای مشخص می کند که افزایش میزان Bcl-xl و Bcl2 در غلاف خارجی ریشه موجب کمک به فعال سازی سلولی میگردد که این امر موجب افزایش انتقال فولیکولها از آناژن به کاتاژن می گردد.
همراه با تولید و ترشح مولکولهای تحریک کننده کاتاژن در کراتینوسیتهای غلاف خارجی ریشه رسپتورهای مرگ آپوپتوتیک همانند Fas ،رسپتور p55- TNF و رسپتور p75 _ نوروتروفین هم به خوبی رسپتورهای TGF-Beta 1/2 بیان می گردند. چنین داده هایی مشخص می نماید که سلولهای غلاف خارجی ریشه نیز از مراکز هدف فعال در طی دوره کاتاژن می باشد. مرکز غلاف خارجی ریشه فولیکولهای مو در فاز کاتاژن بیان بالایی از کاسپاز_۸ را نشان میدهند که سبب انتقال سیگنالهای رسپتور های مرگ با فعال سازی کاسپاز_۳ میگردد.
بیان رسپتور های p75NTR و TGF-Beta در کراتینوسیتهای غلاف خارجی ریشه موجب شکل گیری سلولهای TUNEL + در طی کاتاژن میگردد. در مقایسه با موشهای وحشی در موشهای Knockout p75NTR و TGF-B1 تاخیر واضحی در کاتاژن همراه با کاهش سلولهای آپوپتوتیک در غلاف خارجی ریشه در حال تخریب دیده می شود.
بنابر این با تحریک آپوپتوزیس، نوروتروفینها و TGF-Beta 1/2 ممکن است موجب درگیری بیشتر غلاف خارجی ریشه در دوره کاتاژن فولیکول مو گردد. این داده ثابت می نماید که نوروتروفینها و TGF-Beta2دارای اثرات قوی ایجاد کننده کاتاژن می باشند.
آپوپتوزیس در غلاف خارجی ریشه داخلی تار مو
در طول کاتاژن در کراتینوسیتهای غلاف خارجی ریشه تعداد رسپتورهای Fas/apo افزایش قابل ملاحظه ای می نماید که این امر نشان دهنده درگیری آنها در فرایند آپوپتوزیس می باشد. آنزیم پروتئولیتیک L-cathepsin و بی مویی نیز ممکن است در امر آپوپتوزیس در غلاف داخلی ریشه مو دخالت نماید و به همین دلیل در موشهایی که دارای نقص آنزیم پروتئولیتیک L-cathepsin و بی مویی می باشند آسیب به غلاف داخلی ریشه مو در طول زمان طولانی تری رخ می دهد و همچنین آپوپتوزیس نیز در آنها کاهش می یابد.
اثرات ضد آپوپتوتیک در غلاف خارجی ریشه می تواند توسط Glial cell line–derived neurotrophic Factor و نوروتورین میانجی گری گردد، رسپتور های مرتبط با آنها GFRa1 و GFRa2 نیز در غلاف خارجی ریشه بیان می گردند و موشهایی که نقص در GFRa1 و GFRa2 دارند کاتاژن در آنها با شتاب بیشتری نسبت به موشهای وحشی صورت می پذیرد.
در حال حاضر اطلاعات کمی درباره مکانیسم آپوپتوزیس در کراتینوسیت های تار مو وجود دارد. در کاتاژن در کراتینوسیتهای شافت مو رسپتورهای آپوپتوتیک بیان نمی شوند اگر چه در این محل سلول های TUNEL positive تنها را می توان یافت.
در اواسط کاتاژن و اواخر آن تعداد سلولهای TUNEL + در نزدیکی انتهای تار مو افزایش می یابد این محل منطقه تریشیلیمال کراتینیزاسیون و محل شکل گیری گرز یا کلاب مو می باشد. همانگونه که تغییر رنگ TUNEL همیشه یک نشانه برای آپوپتوزیس سلولی نیست نتیجه گیری نمودن در این باب که چگونه آپوپتوزیس در شکل گیری کلاب و یا گرز مو نقش دارد نیز مشکل می باشد.
چگونگی برداشتن و زدودن سلولهای آپوپتوتیک از فولیکولهای مو در طول دوره کاتاژن
اطلاعات اندکی در دست می باشد که بیانگر مکانیسم کنترل پاکسازی سلول های آپوپتوتیک از فولیکولهای مو در فاز کاتاژن باشد. بر پایه آنچه در مدلهای بیولوژیک قهقرایی دیگر (آنچه در غدد پستانی و یا در اپیتلیوم تیموس رخ می دهد) سلول های آپوپتوتیک توسط فرایند ماکروفاژ و یا توسط سلولهای اپیتلیال همسایه حذف می گردند.
سلولهای دندریت که در فاز آناژن فولیکول های موی انسان در اپیتلیوم دیستال فولیکول مو وجود دارند و موجب بیان C1q می شود ممکن است به صورت تنگاتنگی در شناسایی و فاگوسیتوز سلول های آپوپتوتیک نقش داشته باشند.
سلول های آپوپتوتیک همچنان ممکن است توسط ماکروفاژ هایی که در غلاف بافت همبند وجود دارند و موجب بیان CD68 می شوند، نیز حذف گردند. جالب است بدانیم که مولکولهایی که موجب تحریک روند کاتاژن می گردند همانند اینترلوکین۱ و TNF و TGF-1 به نحو چشمگیری موجب افزایش فاگوسیتوز سلول های آپوپتوتیک توسط ماکروفاژ ها می گردند.
اما با توجه به همه این گزارشات هنوز مکانیسم دقیق موجود در شناسایی و حذف سلولهای آپوپتوتیک در کاتاژن فولیکول مو ناشناخته باقی مانده است. جمعیتی از سلولهای فولیکول که موجب زنده ماندن و برقرار ماندن کاتاژن می گردند.
زنده ماندن جمعیتی از سلول های فولیکول در طول دوره کاتاژن برای بازسازی فولیکول مو در چرخه بعدی رشد مو مورد نیاز است. این جمعیت از سلول ها عبارتند از فیبروبلاستها ی درمال پاپیلا ، و بافت همبند غلاف ،سلول های بنیادی کراتینوسیت و ملانوسیت و برخی از سلول های خواهر آنها(transient amplifying).
در برخی از مطالعات دیده شده است که فیبروبلاستهای درمال پاپیلا مقاومت بالایی به آپوپتوزیس همراه با سطح بالایی از Bcl-2 و فقدان رسپتور های مرگ در طول تمام دوره رشد مو در انسان و موش نشان داده اند.
اما آنها ممکن است مستعد به آپوپتوزیس تحت شرایط آزمایشگاهی باشند (بکار گیری تریپسین و یا سوماتوتروپین) یا تغییرات ژنتیکی. هر چند اکثر سلول های بنیادی کراتینوسیت در طول کاتاژن زنده باقی می مانند اما تعدادی از سلول های bulge تحت آپوپتوزیس قرار می گیرند.
تنظیم آپوپتوزیس در فولیکول مو به عنوان ابزاری در اصلاح رشد غیر نرمال مو :
نقص در نظم آپوپتوزیس در بسیاری از بیماری ها رخ می دهد (هیرسوتیسم و یا حالتهای متفاوت ریزش مو ). اخیرا تعداد زیادی دارو های جدید برای تعدیل آپوپتوزیس ارائه شده است که می توان به TNF-á-inhibiting antibodies, Bcl-2/Bclx L antisense oligonucleotides, synthetic p53, و caspase inhibitors اشاره نمود و برخی از آنها نیز تستهای کلینیکی را نیز با موفقیت از سر گذرانده اند. ثابت شده است که فولیکولهای موی انسان در برخی از حالتهای ریزش مو مانند آندروژنیک آلوپشیا و ریزش مو ناشی از شیمی درمانی تغییراتی را می پذیرد.
شاید مهار کننده های آپوپتوزیس بتوانند جهت کاهش فعالیت آپوپتوزیس در فولیکول های مو در برخی از آلوپشیا ها بکار روند.
توقف فعالیت فارماکولوژیک TGF-2 توسط عصاره گیاهی موجب افزایش رشد فولیکول مو در موش شده است و این امر پیشنهاد می نماید که مهار و یا سرکوب TGF ممکن است در ریزش موی نوع مردانه موثر باشد. این اصل می تواند در آینده به عنوان یک استراتژی در درمان ریزش موی مردانه مورد استفاده قرار گیرد.
✍ دکتر محمد بقایی
عضو انجمن محققین موی سر اروپا
edited by Artan Akheri
References:
۱- Afford S, Randhawa S (2000) Apoptosis. Mol Pathol ۵۳:۵۵–۶۳
۲- Paus R, Cotsarelis G (1999) The biology of hair follicles. N Engl J Med ۳۴۱:۴۹۱–۸
۳- Cotsarelis G, Millar SE (2001) Towards a molecular understanding of hair loss and its treatment.Trends Mol Med ۷:۲۹۳–۳۰۱
۴- Stenn KS, Paus R (2001) Controls of hair follicle cycling. Physiol Rev ۸۱:۴۴۹–۹۴
۵- Lindner G, Botchkarev VA, Botchkareva NV, Ling G, van der Veen C, Paus R, et al. (۱۹۹۷) Analysis of apoptosis during hair follicle regression (catagen) Am J Pathol ۱۵۱:۱۶۰۱–۱۷
۶- Curtin JF, Cotter TG (2003) Live or let die: regulatory mechanisms in Fas-mediated apoptosis. Cell Signal ۱۵:۹۸۳–۹۲
۷- Peters EM, Hansen MG, Overall RW, Nakamura M, Pertile P, Klapp BF, et al. (۲۰۰۵) Control of human hair growth by neurotrophins; brain-derived neurotrophic factor inhibits hair shaft elongation, induces catagen and stimulates follicular transforming growth factor â۲ xpression. J Invest Dermatol ۱۲۴:۶۷۵–۸۵٫
۸- Schultz DR, Harrington WJ (2003) Apoptosis: programmed cell death at a molecular level. Semin Arthritis Rheum ۳۲:۳۴۵–۶۹
۹- van Gurp M, Festjens N, van Loo G, Saelens X, Vandenabeele P (2003) Mitochondrial intermembrane proteins in cell death. Biochem Biophys Res Commun ۳۰۴:۴۸۷–۹۷
۱۰- Puthalakath H, Huang DC, O’Reilly LA, King SM, Strasser A (1999) The pro-apoptotic activity of the Bcl-2 family member Bim is regulated by interaction with the dynein motor complex. Mol Cell ۳:۲۸۷–۹۶
۱۱- Shi Y (2002) Mechanisms of caspase activation and inhibition during apoptosis. Mol Cell ۹:۴۵۹–۷۰